In 2017 leden 10 miljoen mensen aan tuberculose, en 1,6 miljoen van hen stierven aan deze ziekte. Een reden waarom infectie met Mycobacterium tuberculosis zo moeilijk is te bestrijden is dat de bacterie zich kan verstoppen in cellen van het afweersysteem. Onderzoekers van de Rijksuniversiteit Groningen hebben, samen met een internationaal team van collega’s, een belangrijk mechanisme ontdekt wat voorkomt dat het afweersysteem de bacterie kan doden: die produceert een soort maagzuurremmer, wat de afweercellen indigestie geeft. De resultaten zijn op 19 augustus gepubliceerd in het tijdschrift Nature Chemical Biology.
KNCV Tuberculosefonds feliciteert de onderzoekers met hun resultaten; het is van groot belang dat dit soort onderzoek wordt voortgezet en gefinancierd. Deze nieuwe inzichten zouden op langere termijn tot ontwikkeling van nieuwe medicatie voor tuberculose kunnen leiden.
Binnendringende bacteriën worden in ons lichaam opgepakt door afweercellen die macrofagen heten. Zij sluiten de indringers op in een blaasje, het fagosoom, dat dan vervolgens fuseert met een ander blaasje vol met enzymen, het lysosoom. Na deze fusie breken de enzymen de bacterie af. Maar dat gebeurt niet met Mycobacterium tuberculosis: “Die kan jarenlang overleven binnenin een macrofaag, waar hij bovendien buiten bereik is van antibiotica”, vertelt RUG-scheikundige Jeffrey Buter, de eerste auteur van het artikel. Hij werkt al jaren aan tuberculose, zowel aan de RUG (onder leiding van hoogleraar chemie Adri Minnaard) als aan de Harvard Medical School (onder leiding van hoogleraar infectieziekten David Branch Moody). Beide begeleiders zijn hoofdauteur van het artikel.
Virulentie
In een eerdere publicatie presenteerde het team lipiden die aanwezig zijn in M. tuberculosis maar niet in M. bovis, een verwante bacterie die veel minder schadelijk is. Lipiden die alleen in M. tuberculosis voorkomen zouden daarbij een rol kunnen spelen. Dit onderzoek leverde inderdaad een molecuul op dat belangrijk is voor de virulentie, met de naam 1-tuberculosinyladenosine (1-TbAd). Dit is een adenosine waaraan op de 1-positie een lipide is gekoppeld. “Zo’n koppeling komt in de natuur bijna nooit voor”, zegt Buter. “Maar M. tuberculosis produceert relatief veel van dit molecuul en scheidt het bovendien uit.”
Twee enzymen bleken cruciaal te zijn voor de productie van 1-TbAd, maar de manier waarop het molecuul de tuberculose bacterie helpt overleven bleef een mysterie. “Toen vonden we een ouder onderzoek, uit 2004, waarin werd aangetoond dat de fusie tussen fagosomen en lysosomen door deze twee enzymen wordt geblokkeerd. Fagosomen fuseren pas als hun inhoud zuur is geworden. Dat bracht ons op de hypothese dat 1-TbAd er mogelijk voor zorgt dat het fagosoom niet verzuurt.”
Maagzuurremmer
“1-TbAd is een zwak zuur dat in evenwicht is met zijn basische vorm”, vervolgt Buter. “In het zure milieu van een fagosoom zal die base de omgeving minder zuur maken.” Dit suggereert dat het molecuul net zo werkt als gewone maagzuurremmers, en zo voorkomen dat het fagosoom zuur genoeg wordt voor fusie met een lysosoom.
De groep deed een serie experimenten om uit te sluiten dat de adenosine-verbinding zijn werk deed via een indirect mechanisme. Daar kwam uit dat 1-TbAd inderdaad een direct effect had op de zuurgraad. Buter maakte een aantal varianten van het molecuul om te bepalen welke delen ervan belangrijk waren voor de werking. “Het lipide-deel bleek noodzakelijk om door membranen in de cel te kunnen gaan, zodat het in fagosomen en lysosomen terecht kan komen’, vertelt Buter.
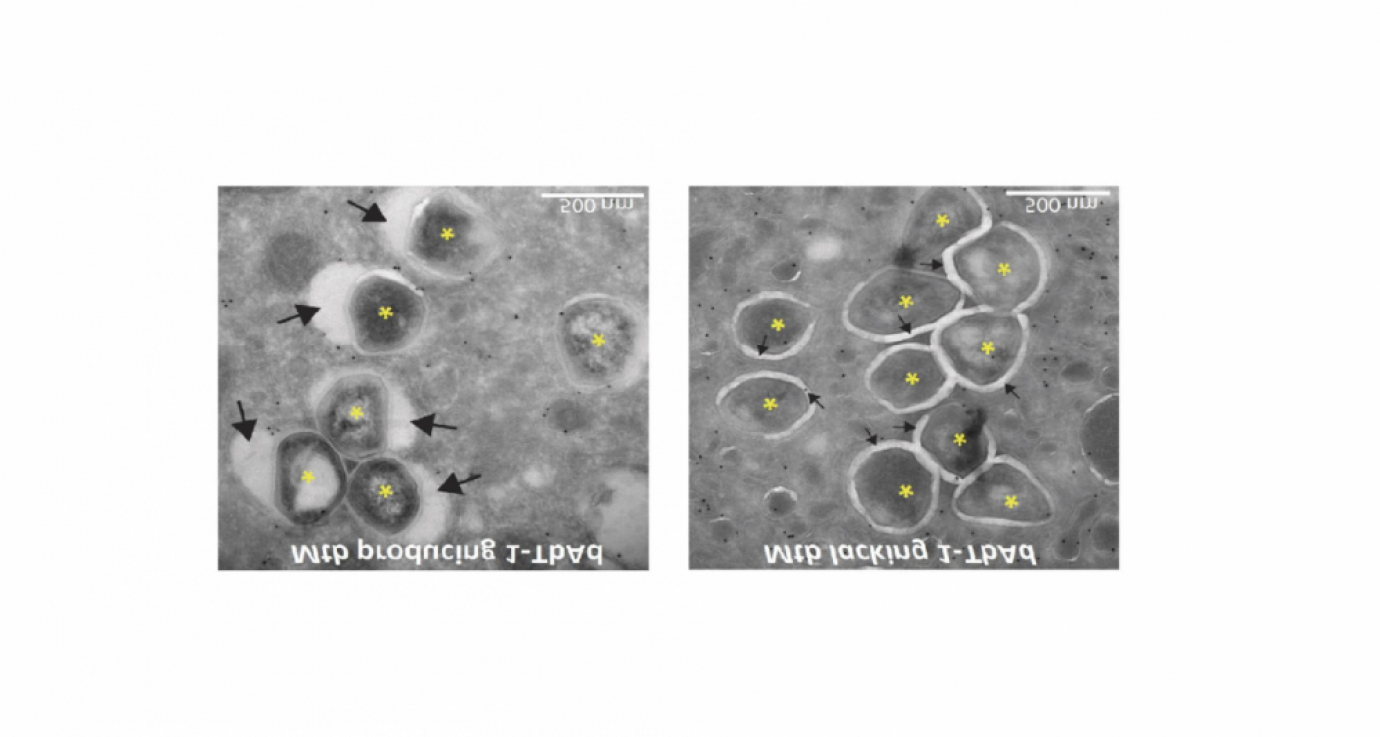
Microscopisch onderzoek in het lab van Nicole van der Wel van het AMC in Amsterdam laten zien dat lysosomen opzwellen tot wel vijf keer hun normale grootte wanneer ze aan 1-TbAd worden blootgesteld. Tests met macrofagen die waren geïnfecteerd met M. tuberculosis lieten zien dat de fagosomen alleen opzwellen in aanwezigheid van het enzym Rv3378c, dat nodig is voor de productie van 1-TbAd. “Er zijn verschillende manieren waarop de bacterie voorkomt dat de macrofaag hem doodt, maar het mechanisme dat wij nu ontdekt hebben lijkt zeer belangrijk te zijn.”
Malaria
Een interessante observatie is dat 1-TbAd volgens hetzelfde mechanisme werkt als het geneesmiddel chloroquine, dat malariaparasieten doodt. “Dat middel blokkeert de werking van de fagosomen van de parasiet.” Dit wijst erop dat 1-TbAd ook ingezet zou kunnen worden tegen malaria. Buter: “Maar bovenal is zou het remmen van de productie van 1-TbAd de bacterie M. tuberculosis kunnen doden terwijl ze in de macrofagen zitten. Het enzym Rv3378c is een interessant doel voor de ontwikkeling van een geneesmiddel tegen tuberculose, aangezien dit enzym alleen in deze bacterie voorkomt.”
Referentie: Jeffrey Buter et al, : Mycobacterium tuberculosis releases an antacid that remodels phagosomes. Nature Chemical Biology 19 augustus 2019 DOI: 10.1038/s41589-019-0336-0
Bron: Persbericht Rijksuniversiteit Groningen